Прочесть «слово» из 13 300 «букв». Интервью с учёным-вирусологом


– Андрей, простыми словами – что такое секвенирование следующего поколения?
– Секвенирование – это метод определения последовательности нуклеотидов в любом геноме, в том числе геноме вирусов.
Первый метод секвенирования придуман в 1977 году, за это в 1980-м была вручена Нобелевская премия Фредерику Сенгеру, английскому ученому. Этот метод был очень трудоемким. Чтобы определить последовательность нуклеотидов в геноме, прочитать «слово» из 200 букв, несколько ученых должны были работать несколько дней, применять радиоактивные реагенты, а точность этого метода была довольно низкой. К концу 80-х годов его удалось автоматизировать, и от нескольких сотен букв удалось перейти к десяткам тысяч. Геном человека был секвенирован методом второго поколения, но на это ушло десять лет.
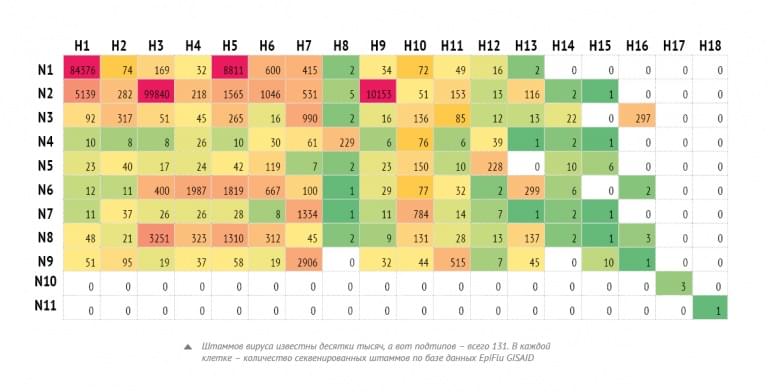
Дальше появились методы нового поколения, в которых процесс распараллеливается – как в компьютерах, когда многоядерный процессор одновременно делает множество вычислений. Другое название метода – массовое параллельное секвенирование. Есть приборы, в которых одновременно протекает много реакций определения последовательностей – такие приборы способны «делать» миллиарды букв за десять часов. На них можно «прочесть» геном человека, не говоря уже о геноме вируса. Сама технология американская, но мы первые в России, кто внедрил эту технологию в надзор за гриппом. За один раз можем отсеквенировать 192 генома вируса гриппа. И мы одними из первых в России стали делать это для первичных материалов.
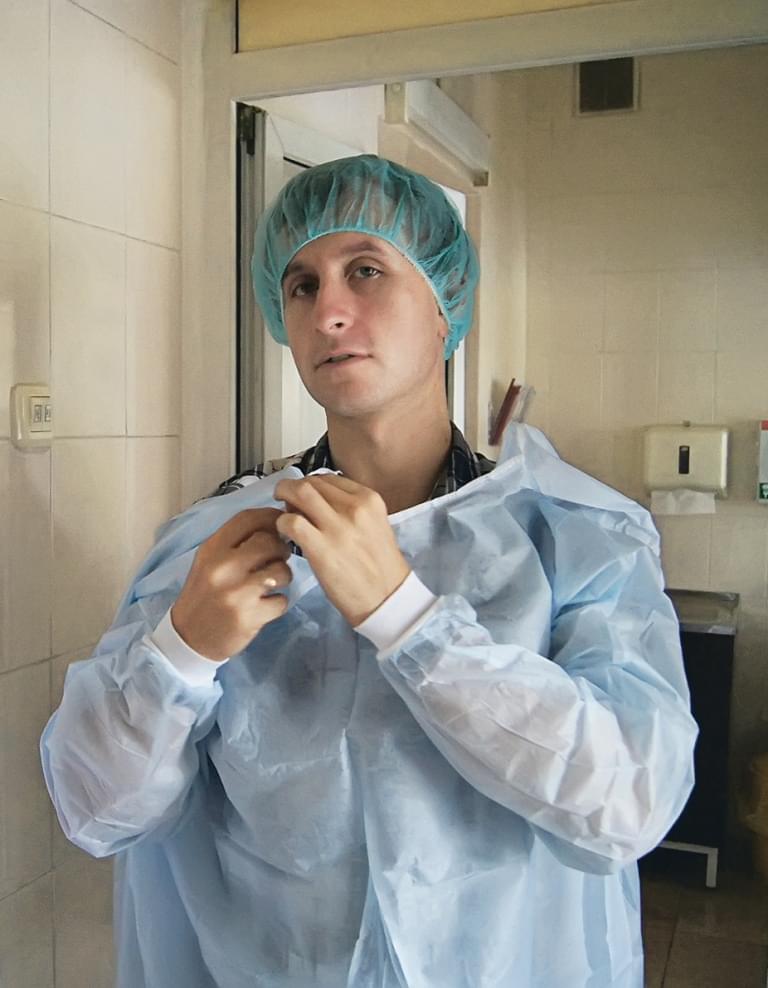
Андрей Комиссаров, заведующий лабораторией молекулярной вирусологии отдела этиологии и эпидемиологии НИИ гриппа им. А. А. Смородинцева Фото: Камила Мирзакаримова
– Что значит для первичных материалов?
– То есть сразу из клеток человека. Как происходит исследование вируса? У больного человека берут мазок из носоглотки специальным аппликатором, внешне напоминающим маленький ершик. На ершике остаются клетки эпителия носовых ходов и слизь. Этот мазок помещается в специальную жидкость: в ней оказываются клетки человека, зараженные вирусом, и вирус, который уже успел выйти из клеток в слизь. Проблема в том, что вируса мало, а клеток человека очень много. В каждой нашей клетке содержится геном из примерно 3 млрд букв. Как найти и прочитать
13 300 вирусных, когда у вас огромное количество человеческого материала? Все равно что искать потерянный блокнотик в публичной библиотеке.
Поэтому исходно ученые брали мазок и вводили этот материал либо в клеточную культуру (например, клетки почки кокер-спаниеля), либо – более классический метод – в куриный эмбрион. Там вирус начинал размножаться и накапливался. Такой выделенный вирус (изолят) проще изучать, потому что его много. Секвенировать вирус из человеческого мазка сложно, но это интереснее, потому что в нем вирус еще такой, какой он у человека. Как только вы начинаете вирус размножать в искусственной системе, он меняется. Мы же применили метод секвенирования нового поколения для первичных материалов: изучаем вирус гриппа непосредственно из клеток человека. В 2016 году мы опубликовали в журнале Influenza and Other Respiratory Viruses статью по гриппу А(H1N1)pdm09: мы сделали для него полное геномное секвенирование из первичных материалов и нашли разные интересные мутации. Это здорово улучшает наши знания о том, какие вирусы циркулируют в России. До внедрения секвенирования нового поколения мы имели очень мало генетических данных. Сейчас совокупными усилиями всех учреждений мы делаем больше 600 полных геномов вирусов гриппа за эпидемический сезон, из них наш институт делает больше 300.
– А что за учреждения занимаются вопросами гриппа?
– Система надзора за гриппом устроена так: есть Всемирная организация здравоохранения (ВОЗ), под ее эгидой в 1947 году создана Глобальная система надзора за гриппом (Global Influenza Surveillance and Response System, GISRS). Есть шесть центров ВОЗ по надзору за гриппом по всему миру. В каждой стране есть один или несколько национальных центров. В России их два.
Национальный центр по гриппу (НЦГ) координирует надзор за гриппом в своей стране. Наш институт организован в 1968 году как головное учреждение СССР по проблеме гриппа и ОРВИ. Это связано с фигурой академика Смородинцева, в честь которого назван институт. Под его руководством разрабатывали первые вакцины от гриппа в СССР. В Москве НЦГ действует на базе института вирусологии им. Ивановского.
В каждом регионе РФ есть Центр гигиены и эпидемиологии, который подчиняется Роспотребнадзору. Центры собирают образцы из больниц, поликлиник и тестируют их, а дальше направляют к нам и в «Вектор» – государственный научный центр вирусологии и биотехнологии в Новосибирске. Поэтому надзором мы занимаемся все вместе.
Центры гигиены и эпидемиологии проводят ПЦР-диагностику: выявляют вирус гриппа в мазках от пациентов. Но дальше нужен более глубокий генетический и вирусологический анализ, а этими компетенциями региональные лаборатории не обладают. Поэтому образцы поступают к нам, в «Вектор» или в Москву. К нам приходят образцы из 50 регионов.
Наш отдел этиологии и эпидемиологии НИИ гриппа по сути является Национальным центром по гриппу России, в его составе четыре лаборатории, моя – лаборатория молекулярной вирусологии. Основная наша задача – надзор за циркулирующими вирусами гриппа и ОРВИ.
В низкотемпературном морозильнике (– 80 °C) хранятся биологические образцы Фото: Камила Мирзакаримова
– Кто составляет эпидемиологическую карту, которая отражает ситуацию по гриппу в России и мире?
– Лаборатория эпидемиологии гриппа и ОРЗ нашего института. Они собирают данные – сколько заболело людей, в каком регионе, каких возрастов. ПО, разработанное в нашем институте, все эти данные аккумулирует, анализирует и визуализирует. Причем еженедельно.
– А какие еще вирусы изучают ученые?
– Если говорить про другие ОРВИ, то в первую очередь это респираторно-синцитиальный вирус человека (hRSV), который особенно опасен для маленьких детей. Дальше аденовирусы, их около 40 генотипов. Если мы говорим о респираторных, в нашей стране обычно это 4-й и 7-й генотипы. Эти вирусы идут следующими после hRSV, они довольно опасны для организованных коллективов: детских домов, домов престарелых, военнослужащих.
Дальше идут вирусы парагриппа человека («пара» означает «около», это другие вирусы, не родственники гриппа, но похожи на него). Еще риновирусы – их мало изучают, большая часть легких простуд, когда у вас недолго легкий насморк и кашель, – это риновирусы. Их более 50, и от них нет вакцин. Дальше есть бокавирусы и коронавирусы: их мало, и их тоже не сильно изучают.
– А как делают препараты против гриппа?
– Существуют два пути. Первый – это скрининг химических соединений. Химики-органики создают огромное количество органических соединений, которых раньше не существовало. Нас интересует, обладает ли новое соединение противовирусной или антибактериальной активностью. Множество химических соединений скринируются на наличие противовирусной активности, также изучается их индекс селективности: нам важно, чтобы вещество убивало вирус, но не убивало клетку. Это проверяется на клеточных культурах, зараженных вирусом. Вы добавляете сотни, тысячи, десятки тысяч химических соединений по одному. Поиск иголки в стоге сена. Сейчас эти процессы автоматизированы, можно скринировать огромное количество веществ, но это случайный процесс.
Другой путь – направленный дизайн. Если вы знаете, как устроен активный центр какого-то вирусного белка, у вас есть его трехмерная структура и огромный багаж других данных, вы можете постараться создать соединение, которое могло бы блокировать этот вирус. Этим занимаются вычислительная химия и хемоинформатика. Путь более сложный, но не такой слепой, как скрининг.
Пробирка с образцами Фото: Камила Мирзакаримова
– Как проверяют противовирусные препараты и вакцины?
– Сначала проводится исследование Proof of Сoncept – доказательство того, что вещество работает. Обычно это делается in vitro (в пробирке). Дальше – доклинические исследования: безопасность препаратов и вакцин тестируют на разных видах животных. Когда показано, что они безопасны, начинается первая фаза клинических испытаний на добровольцах. Их ищут, публикуя объявления.
Кроме того, есть учреждения, которые на коммерческой основе проводят доклинические исследования для фармацевтических и биотехнологических компаний. Поэтому, с одной стороны, это зарегулированная область, а с другой – развивающийся рынок.
– А кто определяет, какая вакцина будет допущена до потребителя?
– Минздрав принимает решение о регистрации вакцины. Выбор штаммов, которые войдут в состав вакцины, – сложный процесс с участием ученых всего мира.
Два или три раза за эпидемический сезон (обычно с конца октября по конец марта – начало апреля) выделенные вирусы отбираются и отправляются в центр ВОЗ. Генетические данные по вирусам, которые мы генерируем, выкладываем в базу данных EpiFlu GISAID. Это глобальная система: к ней подсоединены все, кто занимается надзором за гриппом и его исследованиями в мире. И мы стараемся максимально оперативно отправлять туда данные, которые получаем, потому что они используются ВОЗ при выборе вакцинного штамма на следующий сезон.
Вакцины обновляются, и два раза в год собираются вакцинные совещания: в конце февраля и в сентябре. В феврале – для выбора штамма для северного полушария, в сентябре – для южного. Так ВОЗ аккумулирует все данные и анализирует вирусы, которые каждый национальный центр отправляет в сотрудничающий центр. Проанализировав эти данные, специалисты дают рекомендации по составу вакцины на следующий сезон.
– А вы сами делаете прививки от гриппа?
– Мы все обязаны вакцинироваться, чтобы соответствовать нашим должностям. Прививки делаем и своим детям. Дочери исполняется 1,5 года, и она уже привита – в прошлом году, отечественной вакциной.
– То, что вы ученый, помогает вам лечиться эффективнее, если вы все-таки заболеете?
– Думаю, что нет. С одной стороны, у нас больше доступ к диагностике, мы можем диагностировать грипп сами у коллег. Человеку со стороны нужно обратиться к врачу, чтобы тот взял мазок, направил в лабораторию и т. д. Но сегодня диагностика влечет принятие клинических решений, только если это грипп. Против гриппа есть препараты, а против других ОРВИ специфических препаратов нет.
Поэтому в случае гриппа при своевременно поставленном диагнозе можно начать принимать препарат с действующим веществом осельтамивир, коммерческое название препарата – «Тамифлю». Есть российский дженерик (там то же самое вещество) – «Номидес». Это два самых часто используемых противовирусных препарата от гриппа. Помимо таблеток, есть препараты с тем же механизмом действия, но другим способом введения: ингаляционным и инъекционным. Последний – для тяжелых больных, когда человек в реанимации. Инъекционный препарат в России не зарегистрирован.
Есть еще умифеновир, известный под коммерческим названием «Арбидол». Я не готов говорить о его клинической эффективности, потому что не специалист в этой области, но на молекулярном уровне он действительно подавляет вирусы гриппа и другие РНК-вирусы. Есть еще новые препараты, которые подавляют размножение вирусов гриппа. Но они пока проходят клинические исследования.
Измерение концентрации ДНК Фото: Камила Мирзакаримова
– Но при этом есть люди, которые никогда не болеют гриппом. Почему так происходит?
– Тут очень многое зависит от того, с какими вирусами человек встречался в своей жизни. Например, некоторые пожилые, которые могли сталкиваться с вариантами гриппа свиней 70-х годов (очень известная вспышка гриппа свиней произошла в США на военной базе «Форт-Дикс» в 1976 году), значительно легче перенесли пандемию 2009 года. Человек обогащает иммунологическую память в течение жизни, и если он раньше сталкивался с вирусами, он оказывается более готовым к похожим вирусам.
– А есть ли гены, отвечающие за устойчивость организма к гриппу?
– Сейчас это популярная тема для исследований, но в нашей стране они пока не проводились. Те мировые данные, которые есть, получены на других популяциях людей.
Есть факторы врожденного противовирусного ответа. Это не приобретенный иммунитет, а эволюционно более примитивная система реакции на любой патоген. Самая известная нашумевшая работа посвящена китайцам. Есть такой ген, называется интерферон-регулируемый трансмембранный фактор 3 (IFITM3). Он препятствует проникновению вируса гриппа в клетку. Неважно, что это за вариант гриппа, сталкивался ли с ним человек раньше, – он просто противодействует ему. В Китае есть большая доля населения с мутацией, которая снижает эффективность этого белка и, соответственно, делает людей более подверженным гриппозной инфекции.
Генов врожденного противовирусного ответа очень много, есть такое понятие SNP – однонуклеотидный полиморфизм, это мутации, которые встречаются у людей. Есть огромное количество замен, по которым люди отличаются. Это недостаточно исследовано, потому что генетика человека значительно дороже генетики вирусов. Когда эти методы станут доступнее и каждый человек сможет сделать свой генетический профиль, мы найдем ключи к тому, почему этот человек чаще или реже болеет.
Пока есть некий перечень генов, но из-за того, что по разным этническим группам и разным популяциям мало данных, особенно по России, очень сложно что-то определенно говорить.
Измерение концентрации ДНК Фото: Камила Мирзакаримова
– Есть мнение, что медицинские маски помогут не заразиться гриппом. Так ли это?
– В первую очередь маской должен пользоваться тот, кто болеет, чтобы остановить распространение вирусных частиц. При этом существуют маски и респираторы, которые обладают разной степенью защиты от аэрозолей.
Для респираторов нужно проводить так называемый фит-тест: у каждого человека форма лица разная и разная степень прилегания, то есть степень защиты. Чтобы ее определить, на голову надевают специальный пакет и запускают туда вещество, которое задерживается респиратором, если он сидит хорошо. Иначе вещество вызывает сладковатый привкус во рту.
В случае с медицинской маской, которую вы покупаете за два рубля в аптеке, ни о каком прилегании говорить не приходится. Главная ее функция – остановить капли, зараженный биологический материал, который человек распространяет. И она сокращает количество касаний лица. Если человек болен, слизь покидает носовые ходы, человек касается носа, рта, лица и затем любой поверхности. Потом другой человек касается этой поверхности, затем своего лица и т. д. Больной человек, нося маску, предотвращает распространение аэрозоля и снижает количество касаний лица.
А с точки зрения защиты здорового – если вы наденете специальный респиратор, который довольно дорого стоит, проведете фит-тест на прилегание – да, какое-то время вы будете теоретически защищены.
– В вашем институте есть музей вирусов с коллекцией в 7 тыс. штаммов вирусов гриппа человека. Расскажите немного о нем.
– В нашем музее есть штаммы, которые имеют интересные мутации и фенотипические свойства. Чем интересна эта коллекция – в ней собрано много старых вирусов: 30, 40, 50, 60-х годов. Эта коллекция уникальна. И мы являемся частью европейского вирусного архива (EVAg).
– А существует ли обмен штаммами с зарубежными учеными?
– Да, мы обмениваемся штаммами в первую очередь с сотрудничающими центрами ВОЗ
по гриппу в США и Великобритании. Отправляем им набор репрезентативных штаммов, которые выделили в России, они высылают типовые референсные штаммы и в том числе кандидатные вакцинные штаммы. Таким образом референсные материалы – материалы сравнения для экспериментальной работы – едины во всех лабораториях мира. Также у нас есть тесные научные связи с лабораториями во Франции, Китае, странах СНГ.
– Давайте поговорим о вас. Как получилось, что вы заинтересовались вирусами?
– У меня довольно сложная история. Сначала учился на медицинском факультете СПбГУ, дальше увлекся научной деятельностью, начал еще студентом работать в лаборатории, но по другой теме, не вирусной. Затем я бросил медицину и пошел на биолого-почвенный факультет СПбГУ, и там специализировался по кафедре биохимии. С кафедры биохимии, будучи студентом, я пришел работать в лабораторию тогда молекулярной вирусологии и генной инженерии в 2006 году.
– Можете вспомнить внештатные случаи за годы вашей работы?
– Когда начался пандемический грипп в 2009 году, было лето, период отпускной. Я тогда был лаборантом. Меня вызвали на работу в субботу, в 22:40, когда к нам поступил первый образец с подозрением на пандемический грипп из Боткинской больницы, от какого-то иностранца. Я тогда еще на велосипеде ездил на работу. Приехал, мы начали работать и где-то к двум-трем часам ночи подтвердили. Это был первый случай пандемического гриппа, выявленный 16 июля 2009 года. Я очень хорошо запомнил, потому что у меня были замечательные планы на вечер, которые обрушились. Но я был очень взволнован, мы в первую очередь постарались сделать генетический анализ этого вируса и потом в воскресенье вышли работать и дальше секвенировали его.
Но вообще у нас каждые новогодние праздники бывает интересно. Часто приходится выходить на работу, когда все отдыхают, и работать здесь до 11 вечера каждый день. Дело в том, что вакцинные совещания жестко фиксированы по времени, мы стараемся наибольшее количество данных получить и проанализировать к этому моменту. Так как вирусы не признают праздников, у нас часто получается, что много работы на новогодних каникулах. Мы выходим и запускаем секвенатор – праздничный день, и получается, что в это время не отдыхаем практически.
Но у нас довольно мотивированные люди, и все допоздна остаются. Я, пока был холост, вообще проводил здесь все время.
Секвенатор нового поколения Фото: Камила Мирзакаримова
– Ваша жена тоже ученый?
– Да, мою супругу зовут Ксения. У нас очень много внутриинститутских браков, потому что, когда ты
с 9 утра до 11 вечера на работе, возможности встретиться с кем-то за пределами института резко убавляются. Могу назвать шесть пар наших ровесников, которые здесь образовались. В нашем отделе есть пожилые сотрудники за 60 лет – тоже семейные пары.
– Вы сказали, что запускаете секвенатор даже в праздники. Почему?
– У нас есть капиллярные секвенаторы предыдущего поколения, позволяющие секвенировать отдельные гены гриппа. На похожих приборах сделан геном человека – за десять лет. А секвенатор нового поколения может генерировать миллиарды букв за день, но работа на нем очень дорогая. Один запуск стоит 800 тыс. рублей – потому что дорогие реагенты (кроме того, пошлины – реагенты все импортные). Например, вот такая коробочка стоит 300 тыс. рублей. Поэтому мы запускаем секвенатор четыре раза в эпидемический сезон. Англичане запускают раз в неделю, а американцы еще чаще.
– А что с преемственностью ученых, хватает молодых талантов?
– У нас дефицита талантливой молодежи нет. Был некий провал в 90-х годах из-за того, что многие специалисты уезжали за рубеж. Сейчас такого нет. Хотя, конечно, тоже уезжают. У меня с курса довольно много человек уехало, многие хорошо реализовались за границей.
Я считал и сейчас считаю, что и в наших условиях, сложных с финансовой точки зрения, мы все равно можем стараться делать науку на мировом уровне. Ну и если все уедут, то кто будет заниматься наукой в стране?
фото: pixabay.com
Наука
Камила Мирзакаримова






 Одержимые высотой: история альпинизма
Одержимые высотой: история альпинизма Горами рожденные: кто такие шерпы
Горами рожденные: кто такие шерпы Жизнь рыболовной фермы. Откуда берётся радужная форель?
Жизнь рыболовной фермы. Откуда берётся радужная форель? «В перспективе 10-20 лет у человека отберут право управлять автомобилем»: интервью с челябинским урбанистом
«В перспективе 10-20 лет у человека отберут право управлять автомобилем»: интервью с челябинским урбанистом








